lunes, 11 de junio de 2007
PREPARA TU EVALUACIÒN INSTITUCIONAL
a) Presentan en su capa más externa 8 electrones
b) Pertenecen al grupo B
c) Pertenecen al grupo A
d) La configuración electrónica de su capa más externa está completa de electrones
e) Sus configuraciones electrónicas terminan en los orbitales d y f.
02. Del sistema periódico de los elementos químicos podemos señalar:
a) Los elementos químicos se ordenan según su número atómico
b) Encontramos filas horizontales llamadas periodos
c) Encontramos 18 columnas llamadas grupos
d) Los gases nobles se encuentran ubicados en el grupo 0 o VIII A
e) Todas son correctas
03. Los elementos calcógenos, del grupo VIA de la tabla periódica, tienen una configuración electrónica externa que obedece a la fórmula:
a) ns2 nd10
b) ns2 nd6
c) ns2 np6
d) ns2 np5
e) ns2 np4
04. Los números cuánticos n = 3, l = 1, corresponden a la notación:
a) 3p
b) 3s
c) 3f
d) 1d
e) 1f
05. El número máximo de electrones posible en n = 3 es:
a) 2
b) 8
c) 18
b) 32
e) 12
06. La configuración electrónica de un elemento es 1s2 2s2 2p4. Con esta información, se puede afirmar que dicho elemento
I. se clasifica como representativo.
II. tiene 4 electrones de enlace.
III. pertenece al segundo período y al grupo VIA de la tabla periódica.
Es (son) correcta (s)
a) Sólo I.
b) Sólo II.
c) Sólo III.
d) Sólo I y III.
e) Sólo II y III.
07. La configuración electrónica para el elemento 16S2- puede representarse por
a) [10Ne] 3s2 3p4
b) [10Ne] 3s1 3p7
c) [10Ne] 3s2 3p2
d) [18Ar] 4s2
e) [18Ar]
08. La configuración electrónica del elemento 12Mg establece que la secuencia correcta de números cuánticos principal, secundario y magnético del último electrón son respectivamente
a) n =3, l = 2, m = 0
b) n =2, l = 1, m = +1
c) n =3, l = 0, m = 1
d) n =2, l = 1, m = -1
e) n =3, l = 0, m = 0
09. Respecto de las siguientes configuraciones electrónicas
I. 1s2 2s2 2p6 3s2 3p5
II. [18Ar] 4s2 3d5
III. [18Ar] 4s2 3d10 4p5
Es (son) elemento (s) halógeno (s)
a) Sólo I.
b) Sólo II.
c) Sólo III.
d) Sólo I y III
e) I, II y III.
09. El número cuántico principal (n) tiene relación con
a) el nivel energético de un átomo.
b) el giro del electrón dentro del átomo.
c) el grupo al cual pertenece el átomo.
d) el número de electrones de valencia del átomo.
e) el orbital del átomo.
10. Los números de orbitales que forman los subniveles s, p, d y f son respectivamente:
a) 2, 4, 6, 8
b) 1, 2, 3, 4
c) 2, 6, 10, 14
d) 1, 3, 5, 7
e) 1, 2, 4, 8
11. El número máximo de electrones en los subniveles s, p, d y f corresponden a:
a) 2, 8, 18 y 32
b) 2, 6, 10 y 14
c) 4, 6, 8 y 10
d) 1, 2, 3, 4
e) 2, 5, 7 y 9
12. ¿Cuál de las siguientes afirmaciones corresponde al principio de máxima multiplicidad (regla de Hund)?
a) Orbital es la región del espacio donde está la mayor probabilidad de encontrar un electrón.
b) Los subniveles s, p, d y f contienen como máximo 2, 6, 10 y 14 electrones.
c) El orbital s tiene forma esférica.
d) Los electrones de un orbital deben tener “spins” contrarios.
e) Todos los orbitales de un subnivel son llenados parcialmente, para después ser completados.
13. Un átomo que posee configuración 1s2 2s2 2p6 3s2 3p3, presenta en su capa más externa
a) 1 electrón.
b) 3 electrones.
c) 5 electrones.
d) 7 electrones.
e) 11 electrones.
14. Si la última capa de un átomo neutro posee configuración electrónica 3s2 3p6, su número atómico es
a) 12
b) 14
c) 16
d) 18
e) 20
15. El elemento ubicado en la tabla periódica en el período 4 y en la familia IVA es
a) 6C
b) 14Si
c) 32Ge
d) 50Sn
e) 82Pb
16. Respecto de los siguientes iones
I. 13Al3+
II. 4Be2+
III. 53I-
¿Cuál (es) presenta (n) configuración electrónica de gas noble?
a) Sólo I.
b) Sólo II.
c) Sólo III.
d) Sólo I y II.
e) I, II y III.
17. ¿Cuál configuración es correcta para un átomo en su estado fundamental?
a) 1s2 2s2 3s2
b) 1s2 2p2 3s2
c) 1s2 2s2 3p2
d) 1s2 2s2 2p2
e) 1s2 2p2 2p3
18. Un elemento con configuración basal externa 3s2 3p2 pertenece al:
a) Periodo 3 y grupo IVA
b) Periodo 4 y grupo IIIA
c) Periodo 4 y grupo IIA
d) Periodo 3 y grupo IIA
e) Periodo 2 y grupo IVA
19- Los rayos catódicos se caracterizan por:
a) Ser atraídos por el cátodo
b) No poseer carga eléctrica
c) Estar constituidos por electrones
d) No desviarse frente a un campo eléctrico o magnético
e) Ser visibles
20- Un átomo que tiene número atómico 16 y en el núcleo se distribuye 16 neutrones,
tendrá:
a) Solo I..........................................I.- 16 protones en el núcleo
b) Solo II......................................II.- 16 electrones en su envoltura
c) Solo III..................................III.- 32 como número másico
d) Solo I y II
e) I, II y III
21.- Para un átomo de número másico 40, podemos establecer que tiene:
a) Tiene 40 neutrones
b) Tiene 40 protones
c) Tiene 40 electrones
d) la suma de protones + neutrones es = 40
e) la suma de protones + electrones es = 40
22- Un átomo de un elemento se convierte en su ión si:
a) Solo I........................I.- Gana uno o mas neutrones
b) Solo II.....................II.- Pierde o gana uno o mas electrones
c) Solo III...................III.- Pierde o gana uno o mas protones
d) I y II
e) II y III
23.-Número cuántico que señala el nivel principal de energía y el tamaño del orbital
a) Espin
b) Azimutal
c) Magnético
d) Secundario
e) Principal
24.- De las siguientes propiedades de los átomos, dos tienen el mismo valor numérico y
son:
a) I y II............................................I.- Z
b) I y III........................................II.- Número de protones
c) I y IV........................................III.- Número de neutrones
d) II y III......................................IV.- A
e) II y IV
25.- ¿A qué cantidad de moles de mercurio corresponden 344 g de metal?
MHg = 200,59 g/mol
a) 2,71 moles
b) 1,71 moles
c) 7,71 moles
d) 1,07 moles
e) 1,91 moles
26.- Los isótopos de un elemento se caracterizan por tener igual:
a) Solo I y II .................................. I.- Número de electrones
b) Solo I y III.................................II.- Número másico
c) Solo II y III..............................III.- Número atómico
d) I , II y III
e) Ninguna
27.- El Hierro (Fe) tiene un número másico igual a 56 y el máximo de que
posee es de 26. Con estos datos, se puede afirmar que el número de
neutrones y el número atómico del Fe son:
a) n = 26 nº Z =30
b) n = 56 nº Z =26
c) n = 30 nº Z =26
d) n = 26 nº Z =56
e) n = 82 nº Z =26
28.- El Carbono presenta dos isótopos . Las características común en ellos es
el número de:
a) Solo I ............................................ I.- electrones
b) Solo II...........................................II.- nº
c) Solo III........................................III.- p
d) I y II
e) I y III
29.- Los rayos canales fueron estudiados en los tubos de descarga.¿Cuál es su
característica principal?
a) Su carga eléctrica es negativa
b) Tienen masa suficiente
c) De masa mínima
d) De carga positiva
e) No tienen masa ni carga
30.- Los rayos canales fueron estudiados en los tubos de descarga.¿Cuál es su
característica principal?
a) Su carga eléctrica es negativa
b) Tienen masa suficiente
c) De masa mínima
d) De carga positiva
e) No tienen masa ni carga
31.- ¿Cuál o cuáles de las siguientes afirmaciones acerca del núcleo no es o no son
correctas?
a) Sólo I ...... I.- El núcleo es pequeño en relación al tamaño del àtomo
b) Sólo II.....II.- La carga del núcleo es cero
c) Sólo III...III.- En el núcleo se encuentran los protones y neutrones
d) Sólo I y III
e) I , II y III
32.- Cuando el electrón gira en una orbita determinada no emite
ni absorbe energía, esta en un estado estacionario. El postulado
corresponde al modelo atómico de:
a) Thomson
b) Dalton
c) Rutherford
d) Bohr
e) Goldstein
33.- La relación carga / masa del protón fue determinada por:
a) Millikan
b) Stoney
c) Thomson
d) Goldstein
e) Becquerel
34.- La masa molar para el ácido sulfúrico ( H2 S O4 ) es:
MH = 1 g/mol M S = 32 g/mol M O = 16 g/mol
a) 49 g/mol
b) 98 g/mol
c) 58 g/mol
d) 90 g/mol
e) 92 g/mol
“Quisiera conocer los pensamientos de Dios; el
resto son detalles “
Albert Einstein
martes, 21 de noviembre de 2006
ALCANOS

¿Qué son?
Son compuestos de C e H (de ahí el nombre de hidrocarburos) de cadena abierta que están unidos entre sí por enlaces sencillos (C-C y C-H).
Su fórmula molecular es CnH2n+2, siendo n el nº de carbonos.
¿Cómo se nombran?
Los cuatro primeros tienen un nombre sistemático que consiste en los prefijos met-, et-, prop-, y but- seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos griegos que indican el número de átomos de carbono y la terminación "-ano".
Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo.
Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura.
Se elige la cadena más larga. Si hay dos o más cadenas con igual número de carbonos se escoge la que tenga mayor número de ramificaciones
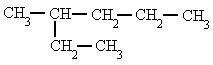 3-Metilhexano
3-Metilhexano
Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible.

2,2,4-Trimetilpentano
Las cadenas laterales se nombran antes que la cadena principal, precedidas de su correspondiente número localizador y con la terminación "-il" para indicar que son radicales.
Si un mismo átomo de carbono tiene dos radicales se pone el número localizador delante de cada radical y se ordenan por orden alfabético.
 2-metil-4-etil-5-propil-octano
2-metil-4-etil-5-propil-octano
Si un mismo radical se repite en varios carbonos, se separan los números localizadores de cada radical por comas y se antepone al radical el prefijo "di-", "tri-", "tetra-", etc.
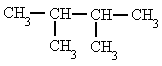 2,3-dimetil-butano
2,3-dimetil-butano
Si hay dos o más radicales diferentes en distintos carbonos, se nombran por orden alfabético anteponiendo su número localizador a cada radical. en el orden alfabético no se tienen en cuenta los prefijos: di-, tri-, tetra- etc. así como sec-, terc-, y otros como cis-, trans-, o-, m-, y p-; pero cuidado si se tiene en cuenta iso-. 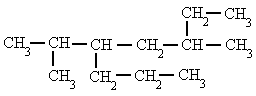 3-metil-5-isopropil-octano
3-metil-5-isopropil-octano
Por último, si las cadenas laterales son complejas, se nombran de forma independiente y se colocan, encerradas dentro de un paréntesis como los demás radicales por orden alfabético. En estos casos se ordenan por la primera letra del radical. Por ejemplo, en el (1,2-dimetilpropil) si tendremos en cuenta la "d" para el orden alfabético, por ser un radical complejo.
 5-(1,2-dimetilpropil)-4-etil-2-metil-nonano
5-(1,2-dimetilpropil)-4-etil-2-metil-nonano
Busca la cadena más larga, en este caso es de 6 carbonos. Numera los carbonos comenzando por el extremo que tenga más cerca una ramificación. Marca los radicales y fíjate a qué carbonos están unidos. Nombra los localizadores seguidos de los nombres de los radicales por orden alfabético. Por último nombra la cadena principal con el prefijo correspondiente y terminada en -ano.
 2,2-Dimetil-4-etilhexano
2,2-Dimetil-4-etilhexano

Escribe la cadena más larga de carbonos, en este caso 5 carbonos. Sitúa los radicales sobre la cadena con la ayuda de los localizadores. Completa el esqueleto de carbonos con hidrógenos hasta completar los cuatro enlaces de cada carbono.
Propiedades físicas.
Punto de ebullición.Los puntos de ebullición de los alcanos no ramificados aumentan al aumentar el número de átomos de Carbono.Para los isómeros,el que tenga la cadena más ramificada,tendrá un punto de ebullición menor.
lunes, 9 de octubre de 2006
Soluciones Químicas
Una solución consta de dos partes; una dispersante,llamada disolvente y que es la que se encuentra en mayor proporción,y al otra dispersa,llamada soluto que es la que se encuentra en menor proporción.
Las soluciones pueden existir en fase sólida,líquida o gas,pero generalmente están referidas al líquido que se obtiene al difundir un sólido,líquido o gas en otro líquido.
La forma en que se puede establecer cuantitativamente la proporción de mezcla, se denomina concentración de una solución y se puede expresar de variadas maneras, siendo las más usadas.
1.- Porcentaje de masa de soluto en masa de solución. % m/m
2.- Porcentaje de masa de soluto en volumen de solución. % m/v
3.- Porcentaje de volumen de soluto en volumen de solución. % v/v
4.- Molaridad. M
5.- Partes por millón. ppm
UNIDADES DE CONCENTRACIÓN
1.- Porcentaje de masa de soluto en masa de solución ( % m/m ):Representa la cantidad en gramos de soluto que hay en 100 gramos de solución.
% m/m = masa de soluto x 100 / masa de soluto + disolvente
2.- Porcentaje de masa de soluto en volumen de solución ( % m/v ): Expresala cantidaden gramos de soluto que hay en 100 ml de solución.
% m/v = masa de soluto x 100 / volumen de solución
3.- Porcentaje de volumen de soluto en volumen de solución ( % v/v ): Expresa los mililitros de soluto en 100 ml de solución. Se utiliza para determinar la concentración de una solución formada por solutos y disolventes líquidos.
% v/v = volumen de soluto x 100 / volumen de soluto + disolvente
4.- Molaridad ( M ): Expresa la cantidad de mol de soluto existente por litros de solución.Luego una solución que contiene 1 mol de soluto por cada litro de ella, se denomina solución 1 Molar y se escribe 1 M.
M = moles de soluto / litro de solución
5.- Partes por millón ( ppm ): Expresa la cantidad de miligramos de soluto por litro de solución. Corrientemente, este tipo de expresión de la concentración, se utiliza para soluciones gaseosas en las que se encuentra uno o varios componentes volátiles y/o particulado en suspensión, como polvos y humos.
ppm = masa en mg de soluto / 1 Lt de solución
EJERCICIOS
1) Se disuelven 50 g de alcohol etílico en 150 g de agua ¿Cuál es el porcentaje en masa de la solución? Resp.: 25 % m/m
2) Una solución de HCl acuosa, tiene una concentración de 37,9 % m/m ¿Cuántos gramos de esta solución contendrán 5 g de HCl? Resp.: 13,2 g
3) Se desea preparar una solución de NaOH al 19 % m/m, cuyo volumen sea de 100 ml ( la densidad de la solución es de 1,09 g/ml )¿Cuántos g de agua y de NaOH se deben usar ? Resp.: 20,7 g de NaOH y 79,3de agua
4) ¿ Qué concentración de % m/m tendrá una solución preparada con 20 g de NaCl y 200 g de agua ? Resp.: 0,09 % m/m
5) Se requiere 30 g de glucosa para alimentar a una rata de laboratorio. Si se dispone de una solución de glucosa al 5 % m/m.¿Cuántos g de esta solución serán necesarios para alimentar a las ratas ? Resp.: 600 g
6) Una solución acuosa esde 35 % m/m ¿Cuánta agua hay que agregar a 80 g de esta solución para que se transforme en una de 20 % m/m ? Resp.: 60 g de agua
domingo, 27 de agosto de 2006
Nomenclatura de Compuestos Binarios
Esta guía tratará solo nomenclatura inorgánica de compuestos binarios más comunes. Por otro lado, para poder aprender nomenclatura, es necesario conocer los símbolos químicos y los estados o números de oxidación de los elementos (Valencias).
REGLA PARA CONOCER EL NRO. DE OXIDACION DE UN ELEMENTO EN MOLECULAS POLIATOMICAS
1.- El número de oxidación del Hidrógeno en sus compuestos es +1, salvo en los hidruros metálicos que es -1.
2.- El número de oxidación del Oxígeno en sus compuestos es -2, salvo en peróxidos que es -1.
3.- Los números de oxidación de los elementos restantes se calcula tomando en cuenta las reglas anteriores, considerando además que la suma algebraica de los números de oxidación de un compuesto neutro es cero y si se trata de un ión es igual a sus carga.
Por ejemplo:
a) H2 S O4 2(+1) + X + 4(-2) = 0
6+
X = 6+ S
+
b) NH4 X + 4(+1) = +1
3-
X = -3 N
CLASIFICACION GENERAL DE LOS COMPUESTOS BINARIOS
Oxigenados: óxidos básicos, peróxidos y óxidos ácidos
Compuestos binarios Hidrogenados: hidruros e hidrácidos
Sales binarias
COMPUESTOS BINARIOS: Formados por dos elementos diferentes
OXIDOS METALICOS O BASICOS: Cuando el metal tiene un solo número de
oxidación, se nombra anteponiendo las palabras “ óxido de …… “al nombre del metal.
Por ejemplo:
M 2 On
n : número de oxidación del Metal
M: Metal
O: Oxígeno
óxido de litio; Li20 , oxido de bario; Ba0 , etc.
Si el metal presenta más de un estado de oxidación, como por ejemplo el Fe con +2 y +3.
En este caso el óxido se nombra escribiendo con números romanos entre paréntesis, el número de oxidación con el que esta actuando el metal. Así, los nombres respectivos para
los óxido de hierro serán:
óxido de hierro (II), FeO y óxido de hierro (III) Fe2O3
Esta modalidad se denomina “Numerales de Stock”. También hay una denominación antigua (forma tradicional), pero que todavía se usa, cuando un metal tiene dos estados de oxidación diferentes. En este caso, el compuesto con el menor de ellos llevará la terminación “OSO“y el de mayor, la terminación “ICO“. Por ejemplo para los óxidos de hierro (II) y óxido de hierro (III).
óxido ferroso; Fe0 y óxido férrico Fe2O3
OXIDOS NO METALICOS O ACIDOS: A estos se les denominó durante mucho tiempo “Anhídridos” .Se forman por un no metal, combinado con oxígeno.
noM 2 Om
m : número de oxidación del no metal
noM : no Metal
Estos se nombran según IUPAC, considerando el número de átomos de oxígeno y del no metal que se encuentran en cada molécula. Para ello se utilizan los numerales griegos como prefijos. Mono (uno), di (dos), tri (tres), tetra (cuatro), penta (cinco), hexa (seis), hepta (siete), etc. Por ejemplo:
Anhídrido nítrico N2O5 pentóxido de dinitrógeno
Anhídrido carbónico CO2 dióxido de carbono
Anhídrido sulfúrico SO3 trióxido de azufre
Anhídrido hipocloroso Cl2O monóxido de dicloro
Anhídrido perclórico Cl2O7 pentóxido de dicloro
PEROXIDOS: Estos son óxidos que se caracterizan por tener dos átomos de oxígeno
2-
unidos entre sí formando el “ión peróxido” O2 , donde cada oxígeno posee número de oxidación 1-.
Por ejemplo:
M2O2n
Peróxido de sodio Na2O2
Peróxido de hidrógeno (agua oxigenada) H202
Peróxido de bario BaO2
HIDRUROS: Formados por hidrógeno y un metal. Se denominan como “ Hidruros de .………” seguido del nombre del metal que lo forma. La carga del hidrógeno en estos compuestos es 1-.Por ejemplos:
M Hn
Hidruro de potasio KH
Hidruro de calcio CaH2
Hidruro de cobre ( II ) CuH2 Hidruro cúprico
Hidruro de cobre ( I ) CuH Hidruro cuproso
HIDRACIDOS: Formados por un no metal e hidrógeno, cuya carga es siempre 1+. Para nombrarlos se aplica el sufijo “ uro “ al nombre del no metal. Por ejemplo:
Hm noM
HF : fluoruro de hidrógeno
H3N : nitruro de hidrógeno ( amoníaco NH3 )
Esta denominación es siempre válida a no ser que se encuentre mezclados con agua, en donde toman la denominación de “ ácido ……..” , seguido del nombre del no metal que lo constituye más el sufijo “ hídrico “. Por ejemplo:
HF(ac) : ácido fluorhídrico
HCl (ac) : ácido clorhídrico
H2S(ac) : ácido sulfhídrico
SALES BINARIAS: Formados por un no metal y un metal. Estos se denominan con el nombre del no metal, agregándole el sufijo “ uro ” y seguido del nombre del metal indicando el número o estado de oxidación del mismo, si es que posee más de un número de oxidación, según “Stock”. Por ejemplo:
Mm noMn
NaCl : cloruro de sodio
FeCl3 : cloruro de hierro ( III ) o cloruro férrico
MgS : sulfuro de magnesio
CuBr : bromuro de cobre ( I ) o bromuro cuproso
A estos compuestos también se les denomina uro compuestos.
EJERCICIOS
I.- Escribir la formula de los siguientes compuestos binarios:
01) óxido de hierro (III)
02) dióxido de silicio
03) telenuro de potasio
04) óxido de cobre (I)
05) cloruro de hidrógeno
06) óxido de sodio
07) dióxido de carbono
08) anhídrido hipocloroso
09) hidruro de cobre (I)
10) monóxido de dicloro
11) selenuro plúmbico
12) anhídrido perclórico
13) dióxido de manganeso
14) óxido mercurioso
15) heptóxido de dicloro
16) trióxido de dinitrógeno
17) ácido bromhídrico
18) ácido sulfhídrico
19) ioduro de hidrógeno
20) sulfuro cúprico
21) sulfuro de hierro (III)
22) peróxido de hidrógeno
23) cloruro de plomo (II)
24) ácido fluorhídrico
25) hidruro mercúrico
26) anhídrido permanganico
27) ioduro de cinc
28) peróxido de calcio
29) óxido de plomo (IV)
30) cloruro de bromo
II.- Escribir todos los nombres posibles para los siguientes compuestos binarios:
01) CuBr2
02) FeO
03) ZnS
04) H2 S
05) HCl (ac)
06) MnO3
07) FeS
08) Br2O5
09) PbTe2
10) Li2O
11) NH3
12) NaCl
13) P2O3
14) HgH
15) CO2
16) HI
17) CuH2
18) CuO
19) AgH
20) MnS2
21) Cu2O
22) CaO2
23) H2O2
24) N2O5
25) HBr
26) Fe2O3
27) CaO
28) ZnCl2
29) Br2O3
30) HI